Fármacos antiobesidad, actualización 2020
Dra. María José Escaffi F.
(mayo 2020)
La obesidad, una enfermedad crónica multifactorial, decretada pandemia desde los 80´s. Lejos de disminuir, esta ENFERMEDAD ha ido en aumento, siendo Chile el país con mayor prevalencia en el mundo (OCDE) con 75% de sobrepeso y obesidad en adultos. Si a lo anterior, sumamos de 9 de cada 10 chilenos es sedentario, el panorama empeora. Es por esto, que junto con reconocer la obesidad como enfermedad y quitarle el estigma asociado, tenemos que quitar el estigma al tratamiento de la obesidad que, junto con cambios en el estilo de vida, puede consistir en el uso de fármacos y/o procedimientos quirúrgicos.
Costó mucho tiempo instalar el concepto de que el tratamiento de la obesidad debe tener un enfoque crónico que implique como base, modificaciones en el estilo de vida desde el principio, pudiendo sumar varios agentes farmacológicos a corto y largo plazo que están disponibles y aprobados, para ayudar con la pérdida de peso en caso necesario. Para esto es necesario una evaluación por un médico especialista, caso a caso, considerando todas las variables que pueden influir en esta enfermedad como muestra esta figura:
Figura 1: Factores implicados en el desarrollo de la Obesidad
Si los pacientes califican, la elección de un fármaco apropiado debe considerar su mecanismo de acción, eficacia y perfil de seguridad, así como la preferencia del paciente y que el beneficio sea mayor que el costo. Asociado a la prescripción farmacológica, el paciente debe entrar a un control multidisciplinario que involucre a enfermer@s para proporcionar educación, seguimiento y motivación continua al paciente, a psicólog@s para identificar trastornos en la conducta alimentaria, reforzar indicaciones y ayudar con los hábitos saludables a adquirir para toda la vida, además de nutricionist@ para educación en alimentación y recomendaciones según la cultura y requerimientos del paciente lo que, sumado a la labor de kinesiólog@s para comenzar, ajustar u optimizar actividad física, crea un círculo virtuoso de manejo y de contención del paciente portador de obesidad1.
A continuación, se describen las terapias disponibles en Chile:
I Monoterapia aprobada para manejo obesidad2
| Fármaco | Mecanismo de acción |
| Fentermina | Derivado de anfetamina (supresor del apetito) |
| Orlistat | Inhibidor de lipasa pancreática |
| Liraglutide 3 mg | Análogo de GLP1 de acción prolongada |
- Fentermina:
Es un simpaticomimético (agonista noradrenérgico oral que suprime el apetito), de acción central relacionada estructuralmente con las anfetaminas que aumenta principalmente la noradrenalina, pero también la liberación de dopamina y serotonina en el SNC. Ha sido el único medicamento aprobado contra la obesidad desde la década de 1950 durante un máximo de 12 semanas de tratamiento, ya que faltan datos de ensayos más largos. Un mecanismo sugerido de acción de la fentermina es a través de la estimulación de la secreción de noradrenalina y el bloqueo de la recaptación de noradrenalina en el hipotálamo, lo que tiene como consecuencia la supresión del apetito y la ingesta de alimentos. Si el efecto anoréxigeno se atenúa (tolerancia) con el tiempo (esto ocurre generalmente dentro de 6-12 semanas), se debe ajustar la dosis, suspender o combinar con topiramato para uso a largo plazo.
La vida media es de aproximadamente 20 horas y el medicamento se excreta principalmente en la orina como un fármaco inalterado. Dentro de los 4 días de suspender la medicación, los niveles plasmáticos deben caer a menos del 5%.
Se aconseja a los pacientes que toman dosis bajas de este medicamento, que tomen la última dosis a más tardar entre las 4 a 5 pm para evitar el efecto secundario del insomnio.
Debe evitarse el consumo de alcohol mientras toma este medicamento. Los efectos secundarios más comunes son el aumento de la presión arterial y la frecuencia del pulso, el insomnio y la boca seca, razón por lo cual, en general se va titulando la dosis (se comienza con dosis pequeñas para probar tolerancia)
Los porcentajes relativos de los eventos adversos más frecuentes son boca seca (38.5%), insomnio (34.5%), mareos (15.1%), palpitaciones (12.4%), enrojecimiento facial (13.8%), fatiga (11.6%) y estreñimiento. (5,5%)2
- Orlistat:
Fue aprobado desde 1998 en Europa y 1999 en EE. UU.
Orlistat funciona inhibiendo las lipasas gastrointestinales y pancreáticas, bloqueando así la hidrólisis de los triglicéridos y reduciendo la absorción de ácidos grasos por el intestino con aproximadamente un tercio de los ácidos grasos de la dieta, por lo que no se absorbe. Orlistat 120 mg se administra tres veces al día con las comidas o como máximo 1 h después de las comidas. Generalmente se tolera bien, pero puede asociarse con una serie de efectos secundarios gastrointestinales como la esteatorrea, que es inherente a su mecanismo de acción.
Los pacientes en tratamiento con Orlistat pueden necesitar suplementos de vitaminas liposolubles (A, D, E y K), para evitar su deficiencia después de su uso a largo plazo, especialmente en los ancianos. Las contraindicaciones para el Orlistat son el embarazo y la lactancia, la colestasis y el síndrome de malabsorción crónica, así como la nefrolitiasis por oxalato. Orlistat es el único medicamento aprobado por la FDA para adolescentes de 12 a 16 años, aunque recientemente se publicó un estudio con uso de liraglutida en adolescentes (lo discutiremos más adelante)3
- Liraglutida en dosis altas:
Liraglutida en dosis altas fue aprobada por la FDA para el manejo de la pérdida de peso crónica el 2014 (Biblioteca Nacional de Medicina de EE. UU., 2019). El glucagón endógeno como el péptido-1 (GLP-1) se libera tras la digestión de alimentos. Cuando estimula los receptores de GLP-1 en el cerebro, induce saciedad y provoca la supresión del apetito. La administración exógena de altas dosis de liraglutida implica una inyección subcutánea una vez al día, independientemente de las comidas. El período de titulación de 5 semanas comienza con una dosis inicial de 0.6 mg, que se incrementa a una dosis final de 3 mg usando incrementos de 0.6 mg para ayudar a minimizar los efectos secundarios gastrointestinales. Si no no se logra al menos un 4% de pérdida de peso desde el inicio al final de la semana 16, se debe suspender la liraglutida ya que es improbable una mayor reducción de peso. Al ser de administración subcutánea (y no oral), requiere una educación adicional sobre la administración adecuada, en qué sitios administrar la inyección subcutánea, el almacenamiento y la eliminación adecuada de objetos punzantes (agujas pequeñas 4 o 5 mm). Además, los pacientes logran los objetivos de HbA1c con dosis altas de liraglutida que con placebo (Davies et al., 2015). Los efectos adversos más comunes son los gastrointestinales como náuseas, vómitos, estreñimiento, dolor abdominal, diarrea y dispepsia, que pueden minimizarse con una titulación más lenta (Biblioteca Nacional de Medicina de EE. UU., 2019). Aunque es raro, se han reportado casos de pancreatitis, incluyendo pancreatitis hemorrágica y necrotizante; por esto, se debe educar a los pacientes sobre los signos y síntomas de la pancreatitis aguda. La liraglutida está contraindicada en pacientes con antecedentes personales o familiares de carcinoma medular de tiroides, tumor de tiroides de células C o síndrome de neoplasia endocrina múltiple (NEM) tipo 2.(1)
Figura 2: Efectos periféricos de GLP-1
Este año, se publicó en New England Journal of Medicine, un artículo sobre el uso de liraglutide en adolescentes, población que en nuestro país también sufre una alta prevalencia de esta enfermedad y hasta ahora, cuentan con escasas herramientas aprobadas para su tratamiento. Se realiza un estudio randomizado, doble ciego que consistió en tratamiento a 56 semanas con período de 26 semanas de seguimiento en 251 adolescentes entre 12 y 18 años portadores de obesidad y pobre respuesta a cambios en el estilo de vida. Se randomizaron 1:1 recibiendo un grupo: liraglutide 3 mg (125 adolescentes) y el otro grupo (126 adolescentes), placebo (manteniendo las recomendaciones de estilo de vida saludable). Finalmente se obtuvo que en el grupo tratado (liraglutida 3 mg más estilos de vida saludable), resultó con una mayor reducción del IMC (índice de masa corporal) en comparación con el grupo placebo.
II Terapias Combinadas (no disponibles en Chile)
| Fármacos | Mecanismo (s) de acción |
| Bupropion + Naltrexona | Inhibidor de la recaptación de dopamina y noradrenalina + antagonista de opioides |
| Topiramato + Fentermina | Anticonvulsivante + derivado anfetaminas (inhibidor del apetito) |
Muchas veces, se combinan estos fármacos de manera independiente para lograr dosis cercanas a las recomendadas por la literatura.
- Bupropión + Naltrexona:
Bupropión está aprobado por la FDA para el tratamiento de la depresión y el abandono del hábito de fumar. Naltrexona más bupropión fueron aprobados para el tratamiento de la obesidad en 2014 en los EE. UU.
El bupropión como monoterapia, produce modestos efectos de la en la baja de peso, que pueden deberse a la activación de los receptores opioides, que pueden suprimir la activación neuronal de POMC (neuronas anorexígenas). Por lo tanto, la adición de un antagonista de los opiáceos como la naltrexona, un antagonista de los opiáceos, se presenta como una forma de lograr una mayor pérdida de peso con el bupropión4.
- Topiramato + Fentermina:
Esta combinación, fue probada para el tratamiento de la obesidad en los EE. UU. en 2012. El topiramato, un monosacárido sustituido con sulfamato derivado de la D-fructosa, disminuye la actividad neuronal del Sistema Nervioso Central y modula la señalización central de glutamato y GABA. Fue aprobado en 1996 por la FDA como un medicamento antiepiléptico (a dosis de hasta 400 mg / día) y en 2004 para la profilaxis de la migraña (a dosis de hasta 100 mg / día). El topiramato en monoterapia induce una pérdida de peso discreta. Los posibles mecanismos de cómo el topiramato induce la pérdida de peso están bajo investigación. La razón para combinar topiramato con fentermina se basó en el hecho de que los efectos secundarios del topiramato están relacionados con la dosis y también con la esperanza de lograr una mayor eficacia2,5.
Tabla 1: Resumen de los fármacos aprobados por la FDA
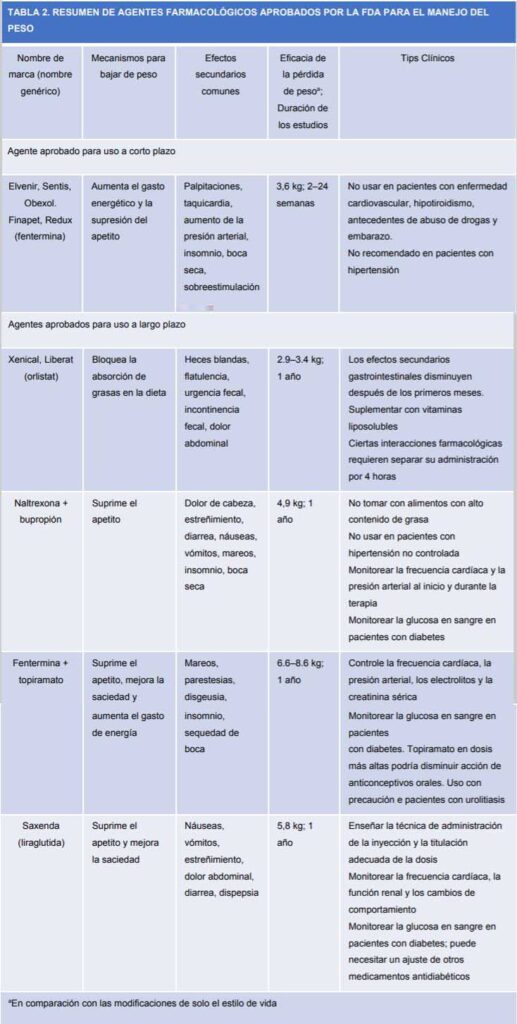
Los investigadores están estudiando nuevos objetivos terapeúticos y ya hay varios fármacos en diferentes fases en espera de resultados para aprobación. Acá les muestro un esquema de los potenciales nuevos enfoques en el manejo de la obesidad:
Figura 3: Nuevos enfoques antiobesidad
Bibliografía:
- Khyati Patel. Obesity Treatment A Focus on Pharmacotherapy of Weight Management Orthopaedic Nursing • March/April 2020 • Volume 39 • Number 2
- Gouni-Berthold et col. Current Options for the Pharmacotherapy of Obesity. Current Pharmaceutical Design, 2019, Vol. 25, nro 18
- Garvey WT et al. American association of clinical endocrinologists and american college of endocrinology comprehensive clinical practice guidelines for medical care of pa- tients with obesity. Endocr Pract 2016.
- Pilitsi E, Farr OM, Polyzos SA, et al. Pharmacotherapy of obesity: Available medications and drugs under investigation. Metabolism 2018.
- Müller TD, Clemmensen C, Finan B, DiMarchi RD, Tschöp MH. Anti-obesity therapy: From rainbow pills to polyagonists. Pharma- col Rev 2018; 70(4): 712-46.




